¿Qué es DADI?
Digital Application Dataset Integration (DADI) es un proyecto de la EMA que reemplazará los formularios de solicitud electrónicos (eAF) en PDF con formularios web en línea para los trámites regulatorios. Los nuevos formularios basados en la web se ajustarán a las Guías de aplicación de la Unión Europea (UE) para la descripción de los datos de los medicamentos humanos y veterinarios, utilizando el estándar de datos Fast Healthcare Interoperability Resources (FHIR), aunque no cambiarán el formato de salida PDF actual.
¿Para qué?
Los formularios web reemplazarán los formularios utilizados hasta ahora en los procedimientos de la UE, incluido el procedimiento centralizado (CP), el procedimiento de reconocimiento mutuo (MRP), el procedimiento descentralizado (DCP) y los procedimientos nacionales (NP); así como los procedimientos de registro de medicamentos de uso veterinario.
¿Por qué?
Se pretende que los formularios basados en la web de DADI permitan un procesamiento de aplicaciones más eficiente, reduciendo la carga administrativa y facilitando la interoperabilidad de los sistemas y el intercambio de información. Los formularios contribuirán también a la validación de las solicitudes por parte de las autoridades competentes, reduciendo errores y discrepancias.
Por otro lado, el uso de datos maestros también significará que las listas desplegables en el formulario tendrán pocas entradas duplicadas o similares, reduciendo su longitud y haciéndolas más fáciles y rápidas de usar.
¿Cómo?
DADI solo podrá ser completado por usuarios registrados en el portal de la EMA y múltiples usuarios podrán estar trabajando sobre él simultáneamente. Una vez completado el formulario web interactivo se generará un documento PDF y un archivo FHIR XML que puede ser leído y procesado informáticamente. La inclusión de ambos en las secuencias eCTD/vNeeS para los trámites regulatorios en los que se requiera será estrictamente obligatorio.
La fuente de datos para este formulario web será SPOR, que acoge información sobre principios activos (Substance Management Service, SMS), productos terminados (Product Management Service, PMS migrado desde el actual xEVMPD (Extended EudraVigilance medicinal product dictionary)), organizaciones (Organization Management Service, OMS) y referencias (Referentials Management Service, RMS).
SPOR es la herramienta de la EMA para implementar las ISO de estándares IDMP (Identification of Medicinal Products), que contribuyen a armonizar internacionalmente los términos para la identificación y descripción de medicamentos:
- ISO 11238 para sustancias activas
- ISO 11240 para unidades de medida
- ISO 11239 para vocabulario sobre formas farmacéuticas, vías de administración, unidades de presentación y packaging
- ISO 11616 para productos farmacéuticos
- ISO 11615 para medicamentos
¿Cuándo?
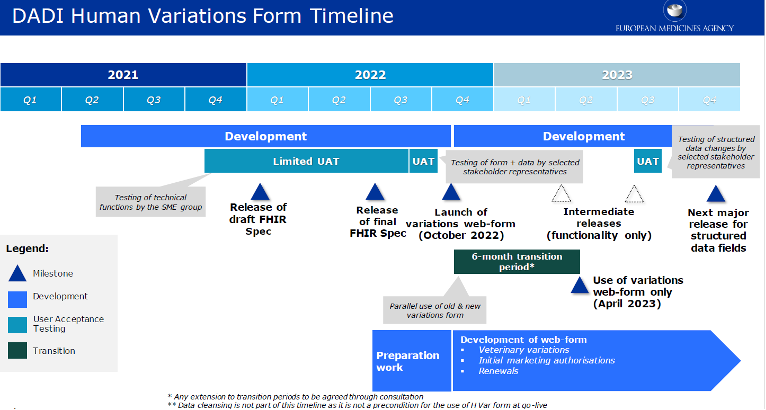
La EMA empezará lanzando el formulario web para variaciones de medicamentos de uso humano en octubre de 2022 en lo que será una primera versión que se mejorará y ampliará en versiones posteriores en 2023.
El alcance de la puesta en marcha de octubre de 2022 se limitará a los productos autorizados centralmente (CAP), una decisión tomada por la EMA debido a la complejidad en la sincronización de los datos entre xEVMPD y PMS. En esta versión inicial del formulario, los datos disponibles para los CAP provienen de la base de datos interna de la EMA siendo el mismo conjunto de datos que se utiliza actualmente en IRIS, la plataforma para gestionar con la EMA procedimientos científicos y regulatorios relacionados con los productos.
Se contempla también un periodo de transición, con un uso paralelo de eAF y DADI, que se alargue hasta abril 2023, fecha para la que ya se espera que el uso exclusivo de DADI sea obligatorio.
Para los medicamentos registrados por el resto de procedimientos, el formulario web podría estar disponible en marzo de 2023, de acuerdo a la información publicada en al propia pagina de la EMA.
Para las solicitudes de variaciones de medicamentos de uso veterinario, de nuevas autorizaciones de comercialización y de revalidaciones los calendarios no han sido fijados con exactitud tras algunos retrasos respecto a las fechas inicialmente previstas.
Para apoyar eficazmente a las partes interesadas antes de la fecha de puesta en marcha, la EMA ha anunciado dos seminarios web públicos de capacitación y preguntas y respuestas:
- 26 de julio de 2022, 11:00-12:30 Hora de Europa Central (CET) – Enlace de registro
- 2 de septiembre de 2022, 11:00-12:30 Hora de Europa Central (CET) – Enlace de registro
- Actualización documentos preguntas y respuestas Julio 2022: https://www.ema.europa.eu/en/documents/other/questions-answers-digital-application-dataset-integration-dadi-product-management-service-pms_en.pdf