En los últimos años, se ha experimentado un aumento significativo del interés por el cannabis medicinal en Europa, lo que ha dado lugar a varios cambios regulatorios. Sin embargo, estos cambios se han producido de forma nacional en cada Estado Miembro, por lo que nos encontramos actualmente ante un panorama heterogéneo que precisa de armonización.
En la actualidad existen diferentes países en Europa que ya cuentan con marcos regulatorios que permiten la comercialización y dispensación de productos a base de cannabis medicinal. Más allá de seguir las vías tradicionales para aprobación de medicamentos en la UE según la Directiva 2001/83/CE, existen países que han realizado modificaciones en su regulación a nivel nacional para la creación de procedimientos simplificados de registro que permitan un acceso más rápido para los pacientes a este tipo de sustancias, preparados y productos medicinales.
MARCO LEGAL DE LAS NACIONES UNIDAS (ONU)
Actualmente, tres convenios de la ONU describen el marco internacional para controlar la producción, comercio y posesión de alrededor de 300 sustancias psicoactivas entre las que se encuentra el cannabis.
En 1961, la Convención Única de las Naciones Unidas sobre Estupefacientes importó el sistema de control de sustancias estupefacientes y cannabis de tratados anteriores y lo elevó a nivel global, considerando como estupefacientes las sustancias naturales o sintéticas incluidas en las listas I y II de las anexas al mencionado convenio. Bajo el sistema introducido, el cannabis fue clasificado como una de las drogas existentes más perjudiciales. Fue a finales de 2020 cuando la Comisión de Estupefacientes de la ONU eliminó tanto al “cannabis (planta de)” como a la “resina de cannabis” de la lista IV de la Convención única de Estupefacientes de 1961, en la que se encontraba junto con otras sustancias potencialmente peligrosas y de escaso beneficio terapéutico. Este hito supuso un paso fundamental para el reconocimiento del potencial médico del cannabis.
MARCO LEGAL Y REGULATORIO EUROPEO
La Agencia Europea del Medicamento (EMA) distingue tres términos en relación con los productos a base de cannabis:
- Producto medicinal derivado del cannabis. De manera similar a cualquier otro producto medicinal derivado de una planta, los productos medicinales derivados del cannabis pueden contener como sustancia activa un constituyente aislado, o sustancia(s) a base de plantas o preparación(es) a base de plantas, o combinaciones de las mismas, que suelen ser más complejas y tienen sus propios estándares de calidad específicos.
- Sustancia a base de plantas. Sustancias herbáceas típicas derivadas del cannabis, como las flores (Cannabis flos) o la resina (Cannabis resina), están cubiertas por la definición de ‘sustancia a base de plantas’ en la Directiva 2001/83/CE y en la monografía de la Farmacopea Europea sobre sustancias a base de plantas.
- Preparación a base de plantas. Éstas incluyen sustancias a base de plantas trituradas o en polvo, tinturas, extractos, aceites esenciales, jugos expresados y exudados procesados.
La seguridad y eficacia de las diferentes sustancias derivadas del cannabis dependen del contenido de los cannabinoides individuales, incluida la proporción entre el Δ9-tetrahidrocannabinol (THC) y el cannabidiol (CBD). Así, se reconocen tres grupos de productos diferentes:
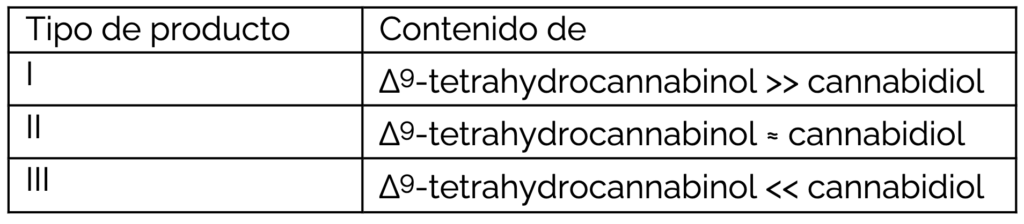
Con carácter general, en la UE, un producto medicinal para uso humano puede ser autorizado tanto a través de un procedimiento centralizado como por las autoridades competentes nacionales mediante un procedimiento de reconocimiento mutuo, descentralizado o nacional. Al solicitar la autorización de comercialización, los laboratorios deben proporcionar documentación que demuestre la calidad, seguridad y eficacia del producto; una documentación que debe generarse en ámbito GxP y prepararse de acuerdo a la Directiva 2001/83/CE, teniendo en cuenta las directrices científicas pertinentes y la base legal elegida por el solicitante.
En concreto para los productos derivados del cannabis, tendrían que considerarse adicionalmente las Buenas Prácticas de Agricultura (GACP) y guías científicas específicas de las sustancias herbales determinadas por la fuente y la parte de la planta. Ambas suelen distinguirse y especificarse en monografías individuales de la Farmacopea Europea, o en su ausencia, en las farmacopeas oficialmente utilizadas en los Estados miembros de la Unión Europea. Las monografías de farmacopea proporcionan definición, descripción, identidad, pureza y ensayos de dosificación de una sustancia herbal.
A día de hoy, algunos Estados miembros de la UE, como Dinamarca, Italia, Holanda o Alemania, han publicado monografías en farmacopeas nacionales. En cuanto a la Farmacopea Europea, el Comité de Medicamentos a base de plantas de la EMA (HMPC) planteó en su plan de trabajo de 2022 tres nuevas monografías para ser estudiadas y evaluadas por sus miembros y observadores: una de flores y dos de extractos. Este plan de trabajo ha dado sus primeros frutos este 2023 con la publicación en Octubre por parte del EDQM de la monografía de la flor del cannabis Cannabis flos (3028), la cual está prevista que se publique oficialmente en la Farmacopea Europea en Julio de 2024.
En el conjunto de los Estados Miembros sí que pueden observarse desde hace algunos años tres grupos claramente diferenciados en cuanto a su disposición para regular el cannabis medicinal: los que ya tienen una legislación bien establecida o están en vías de aprobarla (como es el caso de Alemania y Portugal), los países que permiten el suministro de productos de cannabis bajo condiciones específicas y/o cuentan con programas piloto (como Dinamarca y Francia) y aquellos en los que el uso de esta/s sustancia/s sigue siendo ilegal (como Suecia).
Alemania, en el año 2017 aprobó la «Ley del cannabis como medicamento» («Cannabis als Medizin”) la cual permitió ampliar las opciones para la prescripción de productos farmacéuticos a base de cannabis. Por un lado, a través del registro, mediante la misma vía que los medicamentos tradicionales, de medicamentos con prescripción con principios activos derivados del cannabis(tales como Sativex®, Canemes® o Dronabinol®)
Por otro lado, los médicos podrían recetar flores de cannabis medicinal o extracto de cannabis de calidad farmacéutica con receta de narcóticos.
Resulta especialmente destacable que, en cuanto a la dispensación de flores a pacientes con receta de narcóticos, Alemania ha venido defendiendo y dictaminando que las flores de cannabis medicinal importadas “al por mayor” no han de considerarse, de acuerdo con la normativa aplicable, un producto medicinal, encontrándose este dictamen apoyado por diferentes normativas y legislaciones vigentes (tanto a nivel local como europeo):
- Artículo 3 de la Directiva 2001/83CE del Parlamento Europeo y del Consejo de 6 de noviembre de 2001 por la que se establece un código comunitario sobre medicamentos para uso humano, en su parte descrita como: “La presente Directiva no se aplicará a: Los medicamentos preparados en una farmacia de acuerdo con una prescripción médica destinada a un enfermo determinada (denominada comúnmente fórmula magistral).”
- Las farmacias alemanas en las que se fabriquen medicamentos sobre la base de una receta expedida por personas habilitadas para ejercer la medicina se encuentran bajo la Ordenanza sobre el funcionamiento de las farmacias (Apothekenbetriebsordnung – ApBetrO).
Además de la nueva regulación aplicable, se creó la denominada Agencia del Cannabis (“Cannabisagentur”), dependiente de la Oficina Federal del Opio (BOPST,“Bundesopiumstelle”)y establecida en el Instituto Federal de Medicamentos y Productos sanitarios (BfArM), responsable del cultivo, cosecha, procesamiento, pruebas de calidad, almacenamiento, envasado y distribución controlados de flores de cannabis en farmacias alemanas.
Portugal, por su parte, tiene legalizado desde 2018 el uso terapéutico del cannabis, siendo responsable de su legalización la Autoridad Nacional de Medicamentos y Productos Sanitarios, INFARMED. El marco legal para el uso de medicamentos, preparados y sustancias a base de la planta de cannabis con fines medicinales fue establecido a través de la Ley 33/2018 de 18 de julio, la cual dictamina que:
- Los medicamentos, preparados y sustancias a base de la planta de cannabis para fines medicinales habrían de encontrarse siempre sujetos a autorización expedida por INFARMED, I.P.
- Las indicaciones terapéuticas consideradas adecuadas para los preparados y sustancias basadas en la planta de cannabis con fines médicos habrían de ser aprobadas por INFARMED, I.P.
- Sólo será permitida la prescripción en aquellos casos en los que los tratamientos convencionales con medicamentos autorizados no produzcan los efectos esperados o provoquen efectos adversos relevantes.
La mencionada ley fue regulada por el Decreto-Ley 8/2019, de 15 de enero, que establecía un modelo de tres categorías de productos:
- Medicamentos a base de cannabis. Medicamento que contiene exclusivamente como sustancias activas (i) una o varias sustancias a base de cannabis; (ii) uno o varios preparados a base de cannabis; (iii) una o más sustancias a base de cannabis en asociación o uno o más preparados a base de cannabis.
- Sustancias a base de cannabis. Plantas de cannabis, o partes de ellas, enteras, fragmentadas o cortadas, así como exudados no sometidos a tratamiento específico, u otras sustancias definidas por la parte de la planta de cannabis utilizada y la taxonomía botánica, incluidas la especie y la variedad.
- Preparaciones a base de cannabis. Preparados obtenidos sometiendo sustancias derivadas a base de cannabis a tratamientos tales como extracción, destilación, expresión, fraccionamiento, purificación, concentración o fermentación, como sustancias a base de cannabis pulverizadas o en polvo, tinturas, extractos, aceites esenciales.
Para la comercialización de preparados o sustancias a base de la planta de cannabis con fines medicinales se ha obtener una autorización de comercialización a través del procedimiento nacional simplificado creado para tal fin en el Decreto-Ley 8/2019, de 15 de enero: ACM, Autorização de Colocação no Mercado. El nivel de dispensación de sustancias a base de cannabis con fines medicinales en el país es aún muy bajo, encontrándose tan sólo una sustancia a disposición de los pacientes portugueses: Tilray Flor Seca con un 18% de THC. En cuanto a preparaciones a base de cannabis con fines médicos, por ahora no hay ninguna autorización disponible.
INFARMED ha emitido la autorización de algunos medicamentos a base de cannabis, tales como:
- 2 medicamentos aprobados: Sativex® y Epidyolex®.
- Marinol®, Syndros®.y Cesamet® no tienen autorización de comercialización (MA) pero pueden ponerse a disposición de los pacientes mediante un permiso especial.
Por otro lado, la gran mayoría del resto de países que han legalizado el cannabis medicinal, lo han hecho realizando sutiles modificaciones en su legislación para proceder a la regulación del cannabis medicinal mediante la vía general de los medicamentos.
En 2003, los Países Bajos fueron uno de los primeros países en legalizar el cannabis medicinal en el mundo. Actualmente, además de los medicamentos autorizados, se suministra a los pacientes cinco variedades de cannabis de calidad farmacéutica con una composición de cannabinoides estandarizada bajo supervisión de la Oficina del Cannabis Medicinal (OCM): Bedrobinol®, Bedrocan®, Bedica®, Bediol®, Bedrolite®. Además, lideraron, como RMS, el procedimiento de registro de Sativex®, el único procedimiento descentralizado hasta la fecha.
En cuanto a Italia, autorizó por primera vez el uso de cannabis medicinal en 2013. Los medicamentos basados en cannabis que ya están autorizados en Italia pueden ser recetados a los pacientes por médicos utilizando un formulario especial aprobado por el Ministerio de Salud. Además, los médicos también pueden recetar preparaciones magistrales con productos vegetales a base de cannabis, que generalmente son preparadas por farmacias especializadas.
Polonia por su parte, legalizó el uso del cannabis con fines medicinales en 2017, permitiendo así su registro tanto como materia prima farmacéutica como medicamento.
República Checa, Croacia y Luxemburgo son otros ejemplos de países que emplean el marco legal ya vigente para medicamentos de uso humano y veterinarios.
Por otro lado, países como Dinamarca, Irlanda y Francia, si bien no disponen de una regulación específica para los productos que contienen cannabis medicinal, se encuentran llevando a cabo programas piloto de duración determinada. Estos programas se implementaron con el fin de facilitar a los pacientes el acceso a los productos a base de cannabis para su uso medicinal y poder así determinar si, a largo plazo, se puede generalizar su uso. Existen similitudes entre los diferentes programas, aunque todos ellos están limitados a ciertos productos estandarizados previamente autorizados por las autoridades sanitarias locales entre los que se encuentran productos en forma de flores de cannabis secas, aceites de cannabis, cápsulas, tabletas, soluciones orales, etc .Además, su prescripción, siempre en manos de los médicos autorizados, queda limitada a ciertos criterios establecidos en el programa mientras que la dispensación queda en manos de los farmacéuticos.
Sin embargo, cada país establece sus propios requisitos para con los programas, por lo que surgen también determinadas diferencias: por ejemplo, Francia limita el experimento a aquellos productos terminados que no requieren preparación ni procesamiento, mientras que Dinamarca permite también la prescripción de fórmulas magistrales además de medicamentos no autorizados (Marinol, Nabilone) para su uso compasivo.
En España, el uso del cannabis medicinal no está aún ampliamente regulado, por lo que el cultivo legal de la planta en nuestro país se destina íntegramente para la exportación a empresas debidamente autorizadas. A pesar de haberse constituido la Subcomisión al objeto de analizar experiencias de regulación del cannabis para uso medicinal en el Congreso de los Diputados, y de haberse aprobado el informe sobre el análisis de experiencias de regulación del cannabis para uso medicinal, parece no haber avances legales relevantes. Adicionalmente, es importante indicar que no ha tenido lugar la aprobación de ningún medicamento de cannabis de forma nacional más allá del Sativex® y Epidyolex®.
Es interesante destacar también la cierta homogeneidad que se observa, entre los países, en cuanto a las indicaciones terapéuticas aprobadas en el uso del cannabis: dolor crónico (asociado a enfermedades oncológicas o al sistema nervioso, como dolor neuropático causado por lesión de un nervio, dolor neuropático refractario a terapias accesibles, dolor del miembro fantasma, neuralgia del trigémino o después del herpes zóster); epilepsia y espasticidad dolorosa por esclerosis múltiple u otras patologías del sistema nervioso central parecen ser las más extendidas.
MARCO LEGAL Y REGULATORIOS NO EUROPEOS
Desde noviembre de 2018 el cannabis medicinal es legal en Reino Unido. La reforma legal que dio lugar a este hecho incluía la reclasificación de los productos medicinales derivados del cannabis, sacándo a los mismos de la lista 1 del Reglamento sobre el Uso Indebido de Drogas de 2001 (MDR, Misuse of Drugs Regulations 2001) (sin uso medicinal) para su incorporación a la lista 2, que junto con los opiodes, estarían rigurosamente regulados.
De acuerdo con legislación vigente, los productos a base de cannabis medicinal con fines médicos se encuentran clasificados en dos categorías principales para su comercialización: productos a base de Cannabis para su Uso Medicinal en Humanos (CBPMs, Cannabis-based products for medicinal use in humans), y medicamentos a base de cannabis medicinal.
Desde su legalización se permite, en determinadas circunstancias, la prescripción de productos medicinales derivados del cannabis sin licencia (Unlicensed CBPMs), es decir sin evaluación previa por parte de la Autoridad Reguladora de Medicamentos (MHRA, Medicines and Healthcare Products Regulatory Agency).
Por otro lado, en Suiza, desde el año 2011 y hasta el 2022, estaba autorizado el uso médico del cannabis en circunstancias excepcionales bajo la supervisión de la Oficina Federal de Salud Pública de Suiza (FOPH), la cual permitía el consumo de productos con THC < 1%. Sin embargo, el 1 de agosto de 2022 entró en vigor la Ley de Estupefacientes revisada que permitía ya la prescripción de medicamentos que contengan cannabis por parte de los médicos siguiendo el principio general de libertad terapéutica y deja de requerirse una autorización especial de la FOPH.
El cultivo, la producción, el procesamiento y el comercio de cannabis medicinal sí que están, no obstante, sujetos al procedimiento de autorización de Swissmedic.
CONCLUSIÓN
Los mejores exponentes del avance en la regulación de los productos medicinales a base de cannabis lo constituyen los medicamentos Epidyolex® y Sativex®.
El primero de ellos es el único medicamento, hasta la fecha, registrado por procedimiento centralizado en la Unión Europea (EMEA/H/C/004675) bajo la designación de medicamento huérfano.
Por otro lado, Sativex® supuso, con Delta-9-Tetrahydrocannabinol (THC) y cannabidiol (CBD) como principios activos, el primer medicamento derivado del cannabis registrado vía procedimiento descentralizado en Europa.
Ellos constituyen el mejor marco referente para la ansiada armonización en Europa. La falta de esta armonización legislativa a nivel europeo plantea desafíos en términos de acceso a tratamientos efectivos y coherentes para los pacientes en toda la región. Una legislación más uniforme, precedida de una predisposición legislativa similar en todos los Estados Miembros, podría contribuir además a la reducción de la estigmatización asociada al cannabis medicinal, fomentando un enfoque basado exclusivamente en la evidencia científica y la atención médica adecuada.
BIBLIOGRAFÍA
- Convención Única sobre estupefacientes de 1961, de las Naciones Unidas.
- DIRECTIVA 2001/83/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 6 de noviembre de 2001 por la que se establece un código comunitario sobre medicamentos para uso humano.
- Ley del cannabis como medicamento («Cannabis als Medizin”)
- Ley 33/2018 de 18 de julio
- MDR, Misuse of Drugs Regulations 2001
- Decreto-Ley 8/2019, de 15 de enero
- Resolución nº 11/CD/2019
- Heads of medicines agencies: National contacts. Hma.eu. Disponible en: https://www.hma.eu/human-medicines/national-contacts.html
- Homepage. Europa.eu. Disponible en: https://www.ema.europa.eu/en/homepage
- Swissmedic ©. Copyright. Home. Swissmedic.ch. Disponible en: https://www.swissmedic.ch/swissmedic/en/home.html
- England NHS. NHS England. Nhs.uk. Disponible en: https://www.england.nhs.uk/
- About us. Gov.uk. 2014. Disponible en: https://www.gov.uk/government/organisations/medicines-and-healthcare-products-regulatory-agency/
- Council of Europe. Home – focus. Council of Europe. 2023. Disponible en: https://www.edqm.eu/en/


